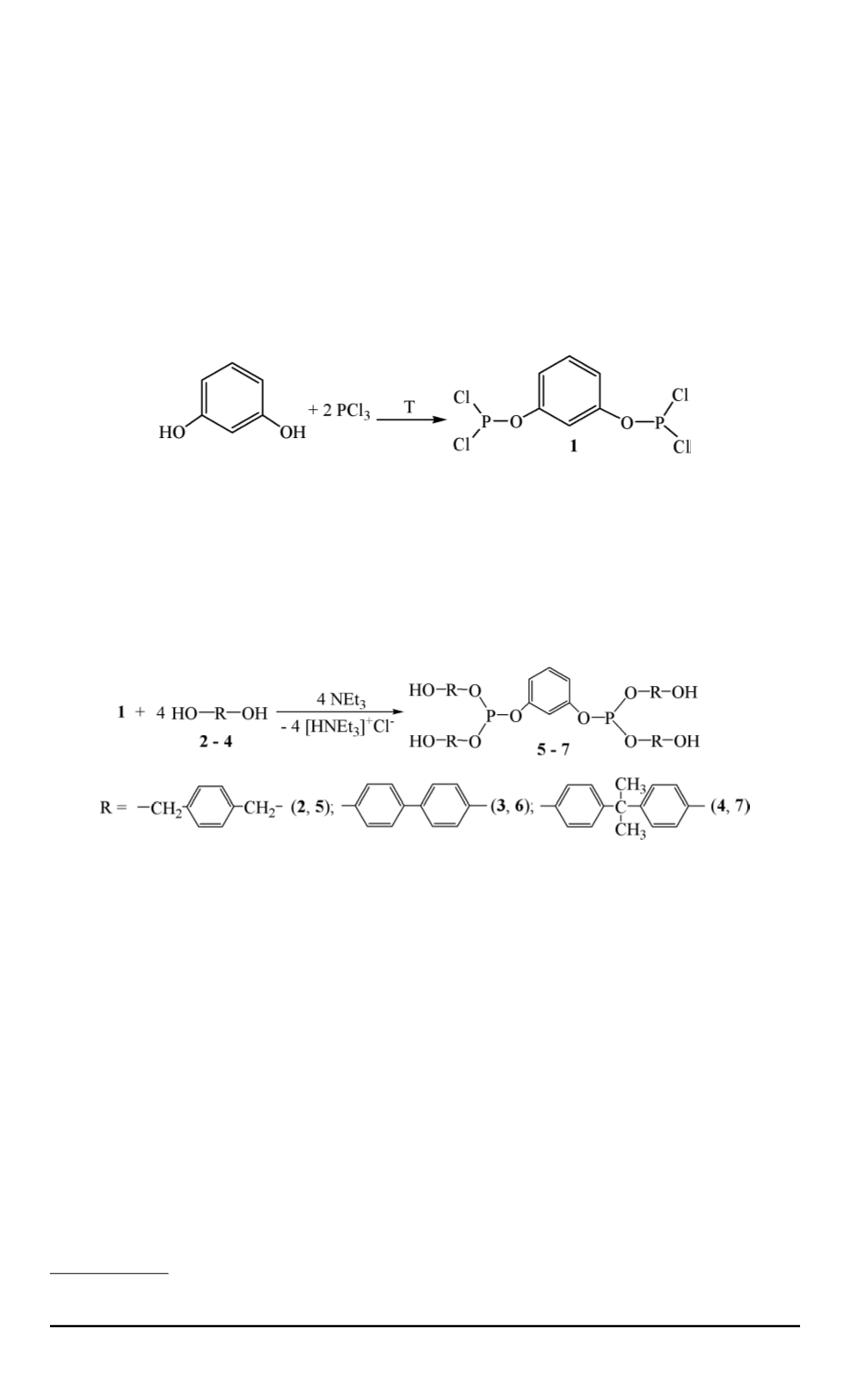
(ДИАН), являющиеся двухатомными фенолами. Указанные диолы
достаточно подробно изучены в реакциях фосфорилирования как
объекты для создания циклических конструкций типа циклофанов и
фосфокраун-эфиров [6–9].
Для синтеза исходных тетраолов вышеуказанные ароматические
диолы закрепляли на фосфорсодержащей матрице, в качестве которой
был использован впервые синтезированный 1,3-бис(дихлорфосфито-
кси)бензол
1
. Тетрахлорангидрид
1
получали путем кипячения резор-
цина в треххлористом фосфоре в течение 10 ч с последующей пере-
гонкой продукта в вакууме (при температуре 139. . . 140
◦
С и давлении
1 мм рт. ст.):
В спектре ЯМР
31
Р соединения
1
фиксировали синглетный сигнал с
химическим сдвигом 178.6 м.д., что соответствует дихлорангидридам
фосфористой кислоты с ароматическими заместителями [10].
Синтез тетраолов (
5 - 7
) проводили при комнатной температуре в
присутствии триэтиламина NEt
3
в качестве акцептора выделяющегося
хлороводорода при соотношении реагентов
1 : 4
. Протекающую при
этом реакцию можно отразить следующей схемой:
Через 2 ч от начала реакции в спектре ЯМР
31
Р реакционной мас-
сы фиксировали синглетный сигнал с химическим сдвигом 137.4 м.д.
(в случае тетраола
5
) или 127.3 м.д. (в случае тетраолов
6, 7
), харак-
терный для триэфиров фосфористой кислоты указанного типа. Обра-
зующиеся соединения
5–7
были выделены методом переосаждения с
выходами 40. . . 68%. При этом тетраол
5
представлял собой бесцвет-
ный гель, тетраол
6
— бесцветный порошок, а тетраол
7
— вязкое ма-
сло. Все образующиеся вещества плохо растворялись в органических
растворителях.
Структура синтезированных соединений
5–7
была доказана ме-
тодом спектроскопии ЯМР
1
Н
)
. Так, в случае тетраола
7
в области
сильных полей фиксировались два синглетных сигнала с химически-
ми сдвигами 1.59 и 1.61 м.д., соответствующие неэквивалентным в
)
Внутренний стандарт ТМС, растворитель —
d
-ацетон (СD
3
)
2
CO.
120
ISSN 1812-3368. Вестник МГТУ им. Н.Э. Баумана. Сер. “Естественные науки”. 2009. № 4


