
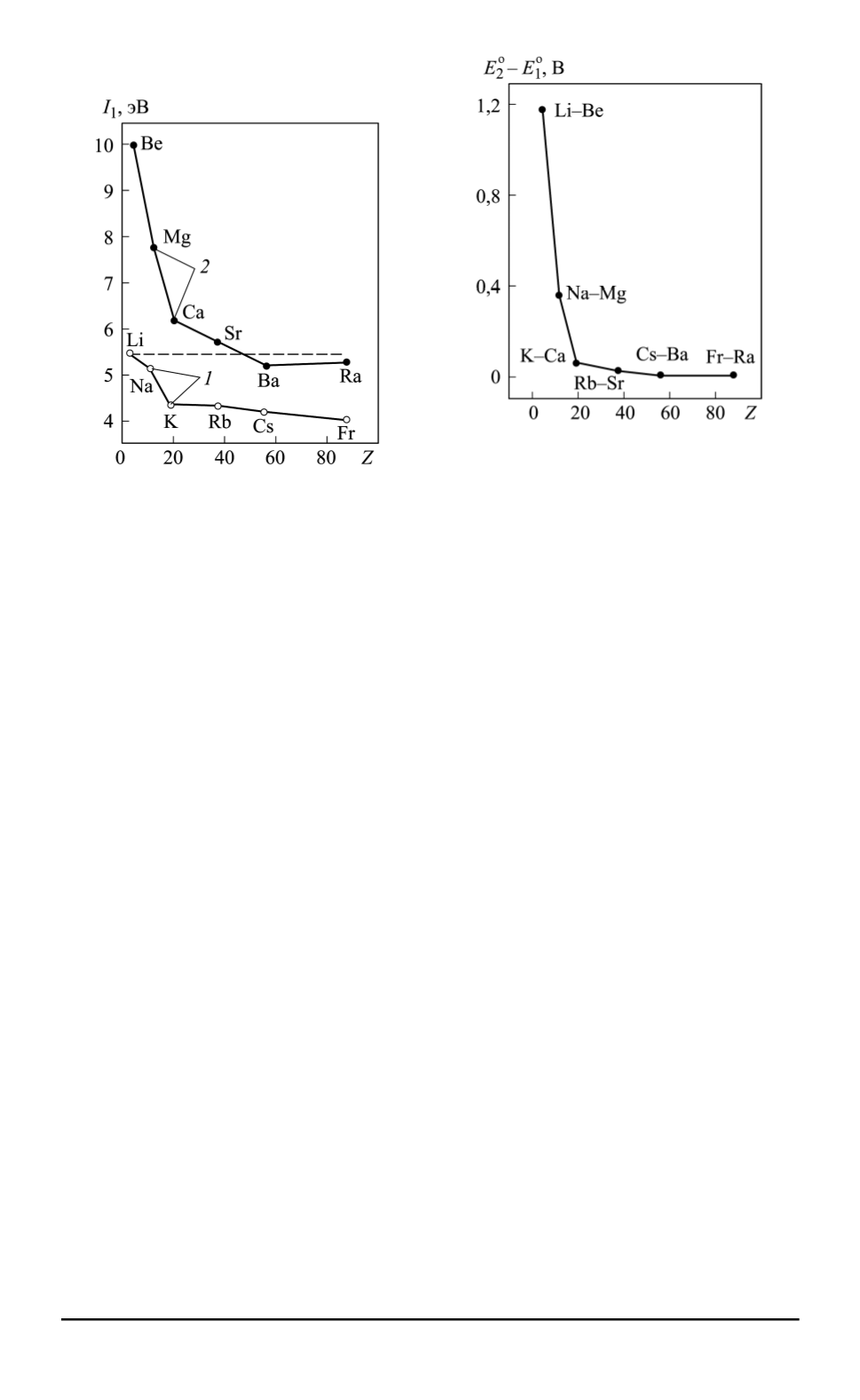
Рис. 1. Зависимость первых энергий
ионизации
I
1
щелочных (
1
) и щелоч-
ноземельных (
2
) металлов от атомно-
го номера
Z
[8]
Рис. 2.
Зависимость разности
стандартных электродных потен-
циалов (
Е
◦
) пар
М
(1
+
)
/M
(
Е
◦
1
) и
М
(2
+
)
/M
(
Е
◦
2
) элементов первой
и второй групп [9] от атомного
номера
Z
Значения электродных потенциалов, измеренные в водных растворах,
демонстрируют ту же тенденцию: разность стандартных электродных
окислительно-восстановительных потенциалов пар элементов одно-
го периода второй и первой групп (
Δ
Е
◦
=
Е
◦
2
−
Е
◦
1
) неотличима от
нуля только для двух пар Ra(2+)/Ra–Fr(1+)/Fr и Ba(2+)/Ba–Cs(1+)/Cs
(рис. 2). Это свидетельствует о близости химических свойств бария и
радия со свойствами их щелочных тип-аналогов — цезия Cs и франция
Fr соответственно. Что касается свойств химических соединений, то
различие элементов первой и второй групп, а также элементов вто-
рой группы, еще более резкое. Эта особенность наглядно проявляется
при сопоставлении свойств гидроксидов щелочных и щелочноземель-
ных металлов. Элементы первой группы образуют щелочи, хорошо
растворимые в воде и в большинстве полярных органических раство-
рителей. Напротив, во второй группе только гидроксиды бария и радия
умеренно растворяются в воде, образуя сильные основания (щелочи).
Растворимость остальных гидроксидов монотонно убывает в порядке
уменьшения заряда ядра, а гидроксид Ве(ОН)
2
не только практически
нерастворим, но и проявляет амфотерные свойства, что совершенно
нехарактерно для щелочных элементов.
Из всех элементов второй группы только барий аналогично ще-
лочным металлам образует при нагреве на воздухе ВаО
2
. Пероксиды
более легких щелочноземельных элементов получаются только кос-
венным путем.
118
ISSN 1812-3368. Вестник МГТУ им. Н.Э. Баумана. Сер. “Естественные науки”. 2015. № 5
















