
Моделирование кинетических процессов растворения оксидов кобальта и меди в серной кислоте
ISSN 1812-3368. Вестник МГТУ им. Н.Э. Баумана. Сер. Естественные науки. 2017. № 3
125
исходит растворение оксидов, тем хуже его стабильность. Это особенно важно
при выборе катализатора в химической реакции.
Систематические исследования растворения оксидов металлов позволяют
количественно описать процессы растворения оксидов, связать поверхностные
электрохимические явления на оксидах кобальта и меди с их кислотно-
основными свойствами и механизмом растворения [15–21].
Цель настоящей работы
— изучить кинетику растворения оксидов ко-
бальта Со
3
О
4
и меди CuO в растворе серной кислоты H
2
SO
4
различной концен-
трации, провести моделирование процессов растворения оксидов с позиций
гетерогенной кинетики.
Методика изучения кинетических закономерностей растворения оксидов
кобальта и меди в серной кислоте.
Для кинетических исследований выделялись
фракции оксидов Со
3
O
4
и CuO размером 80…100 мкм. Идентификацию исходных
образцов оксидов проводили методом инфракрасной спектроскопии. Спектры
образцов получали на спектрометре ИКС-16 и двухлучевом инфракрасном
спектрофотометре UR-20. Термический анализ оксидов кобальта, никеля, железа и
меди осуществляли на приборе ДТА-М-5.
Навеска оксидов массой 0,3 г вводилась в термостатируемый реактор, со-
держащий 0,5 л водного раствора серной кислоты заданной концентрации. Рас-
творение оксидов проходило при непрерывном перемешивании с постоянной
скоростью 800 мин
–1
при различных значениях температуры (298…343 K). Кон-
центрацию ионов кобальта определяли спектрофометрическим роданидным
методом, ионов меди — с помощью формальдоксима.
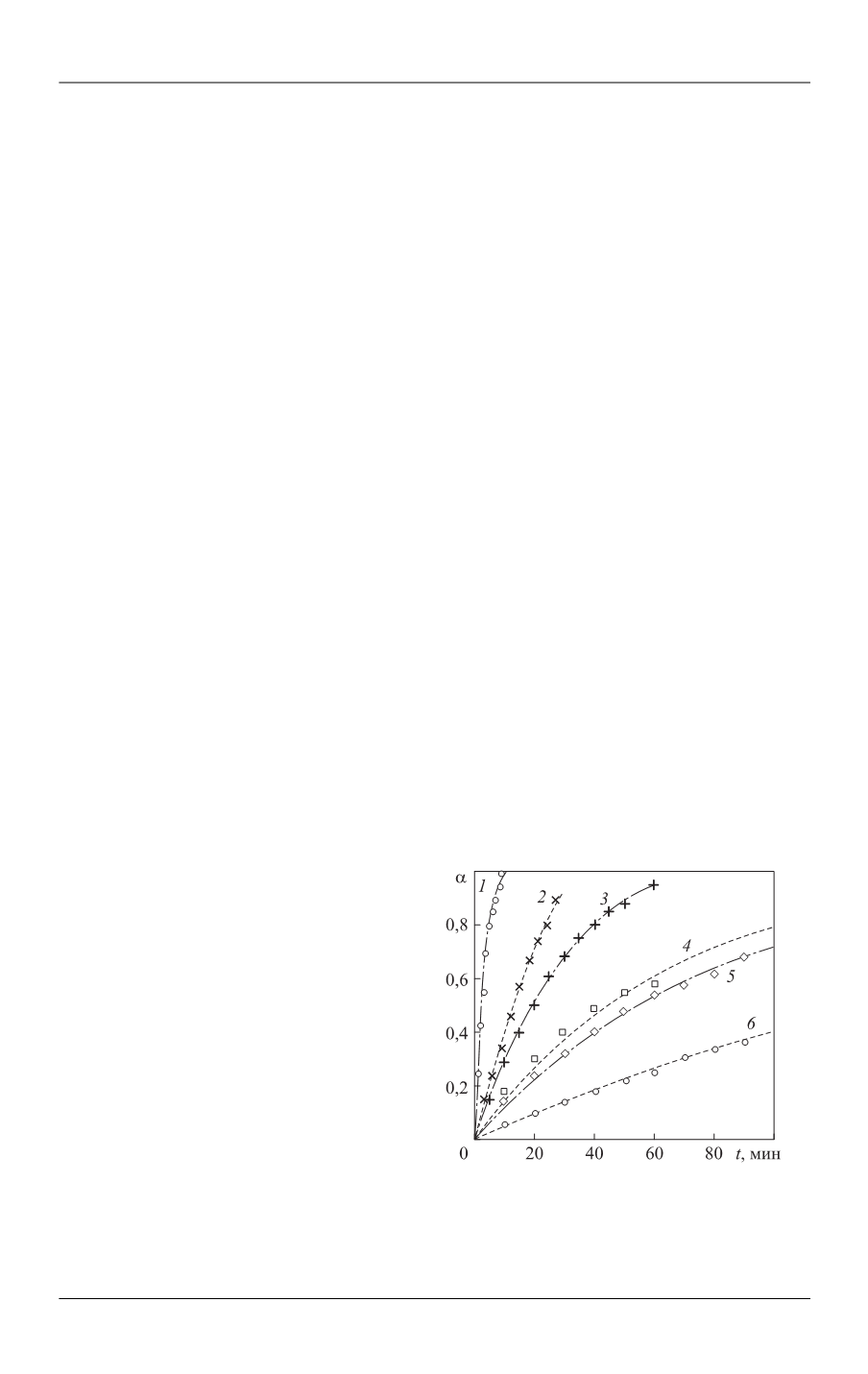
Полученные экспериментальные данные по влиянию концентрации, рН и
температуры на кинетику растворения оксидов кобальта и меди представлены в
координатах
α
–
τ
на рис. 1 и рис. 2. Значения величины
α
рассчитаны по урав-
нению
∞
α =
/ ,
t
D D
где
α
— доля растворенного оксида;
D
t
,
D
∞
— оптические
плотности фильтрата в моменты времени
t
и
t
=
∞
, когда происходит полное
растворение оксида [22–30].
Рис. 1.
Зависимость доли растворен-
ного оксида кобальта Со
3
О
4
от времени
при значениях концентрации серной
кислоты 10 (
1
), 5,93 (
2
), 2,97 (
3
), 1,0 (
4
),
0,57 (
5
), 0,12 (
6
) моль/л при
Т
= 363,2 K
(точки — экспериментальные данные,
линии — расчетные значения, получен-
ные по (1))
















