
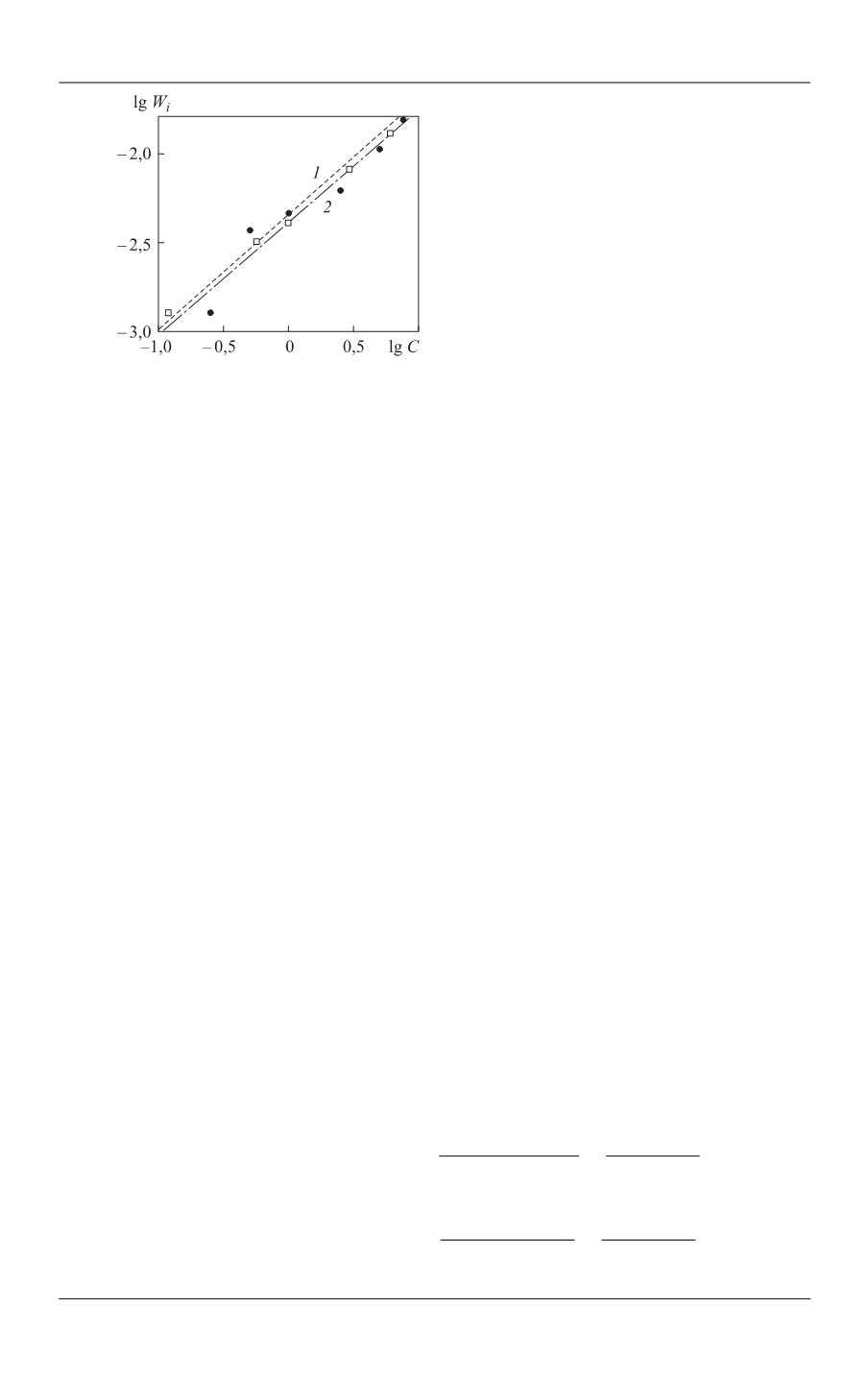
Е.А. Якушева, И.Г. Горичев, О.Н. Плахотная
128
ISSN 1812-3368. Вестник МГТУ им. Н.Э. Баумана. Сер. Естественные науки. 2017. № 3
Моделирование механизма растворения оксидов кобальта и меди в серной
кислоте.
Согласно существующим представлениям, процесс растворения оксидов в
кислотах происходит на активных центрах оксидов, адсорбировавших ионы H
+
и
ионные пары Н
+
–А
−
. Существуют различные методы математического моделиро-
вания процессов растворения: метод маршрутов; метод стационарных концентра-
ций; метод линейных последовательностей; метод Хоугена —Ватсона [25, 28].
Здесь был выбран метод Хоугена — Ватсона, который позволил провести
моделирование зависимости скорости растворения оксидов от рН и концентра-
ции кислот.
В этом случае скорость растворения (например, оксидов кобальта), в общем
виде, будет выражаться уравнением [25, 28]:
( )
0
Г H Г(MOH ),
i
W W
+
+
=
где
Г( )
⋅
— адсорбция соответствующего иона.
Представляло интерес выяснить, какие промежуточные частицы участвуют в
растворении оксидов. При этом предполагалось, что на поверхности оксидов об-
разуются частицы гидроксокомплексов кобальта такого же состава, что и нахо-
дящиеся в растворе. Для расчета их концентрации применяли системы уравне-
ний: материального баланса по базовым компонентам реакции гидролиза (ионы
водорода и кобальта); системы уравнений ступенчатого гидролиза (уравнений
закона действующих масс) с учетом ступенчатых констант гидролиза [7, 11]. Со-
гласно методу Хоугена — Ватсона, для установления связи между поверхностной
и объемной концентрацией различных ионов кобальта и меди (II) предполага-
лось, что зависимость концентрации ионов на поверхности оксидов и в растворе
подчиняется изотерме Ленгмюра.
Зависимость удельной скорости растворения оксидов кобальта и меди в
разбавленной серной кислоте выражается следующими уравнениями:
+
+
+
+
+
+
=
=
+
+
2
2
0
0
2
1
2
CоOH
H
Г(CоOH )Г(H )
;
CоOH
H
i
W W
W
K
K
+
+
+
+
+
+
=
=
+
+
0
0
1
2
CuOH
H
Г(CuOH )Г(H )
.
CuOH
H
i
W W
W
K
K
Рис. 4.
Зависимость lg
W
i
[lg
C
(H
2
SO
4
)]
для моделей Бартона — Странского
при растворении оксидов кобальта
Со
3
О
4
(
1
) и меди CuO (
2
) в серной
кислоте (точки — экспериментальные
значения, линии — графическое
изображение зависимости (2))
















