
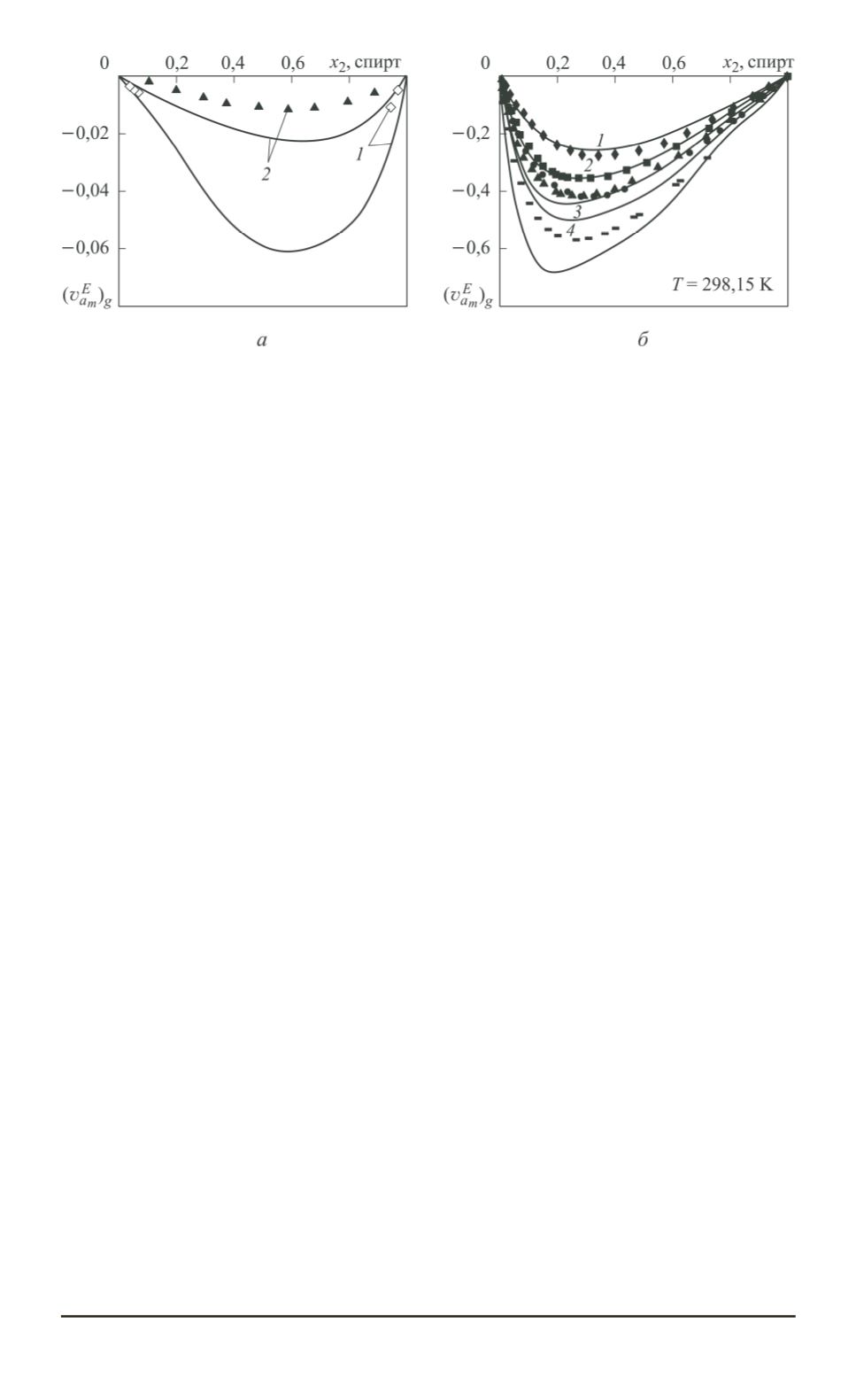
Рис. 4. Изотермы вклада геометрического фактора в величину
v
E
a
m
и отклоне-
ния кажущегося удельного объема от (3) для растворов (
а
) С
8
Н
18
–спирт СН
3
ОН
(
1
) и С
2
Н
5
ОН (
2
) и для водных растворов спиртов (
б
) СН
3
ОН (
1
), С
2
Н
5
ОН (
2
),
С
3
Н
7
ОН (
3
), С
2
Н
4
(ОН)
2
(
4
), С
3
Н
5
(ОН)
3
(
5
) (штриховая линия построена по
расчетам первого слагаемого выражения (8), ,
N
— по экспериментальным
данным мольного объема, взятым из работ [21] (
а
) и [22–24] (
б
))
спиртов по сравнению с неводными. Вследствие увеличения разли-
чий геометрического строения воды и спиртов (для
n
= 1
k
= 3
,
1
,
|
Δ
у
|
= 0
,
138
; для
n
= 2
k
= 4
,
6
,
|
Δ
у
|
= 0
,
156
; для
n
= 3
k
= 6
,
1
,
|
Δ
у
|
= 0
,
176
) абсолютное значение первого слагаемого выражения
(8) возрастает с увеличением номера
n
. Она вносит основной вклад
в отклонение кажущегося удельного объема от (3) (рис. 4,
б
). Одна-
ко при концентрациях воды не менее 0,9 мольных долей заметный
вклад (
∼
30
%) вносят межмолекулярные взаимодействия вследствие
сил притяжения. При концентрациях спирта не менее 0,8 мольных
долей уплотнение структуры водного раствора относительно линей-
ной зависимости (5) уменьшается при переходе от системы вода–
метанол к системе вода–этанол. В системе Н
2
О–пропанол наблю-
дается разрыхление структуры раствора при любой концентрации
относительно модельного раствора, в котором межмолекулярные вза-
имодействия между частицами одинаковы. При переходе от водных
растворов моноспиртов к полиспиртам абсолютное значение вклада
геометрического фактора увеличивается вследствие роста различий
геометрического строения воды и полиспирта (для Н
2
О–
C
2
H
4
(OH)
2
k
= 5
,
5
,
|
Δ
у
|
= 0
,
279
; для Н
2
О–
C
3
H
6
(OH)
3
k
= 7
,
8
,
|
Δ
у
|
= 0
,
336
). В
то же время возрастает разность межмолекулярных взаимодействий
вследствие сил притяжения. При переходе от водных растворов мо-
носпиртов к водным растворам полиспиртов с одинаковым числом
атомов углерода увеличивается более чем на порядок разность энер-
гий когезии: Н
2
О–этанол
|
Δ
Е
|
= 1
,
6
кДж/моль
→
Н
2
О–этиленгликоль
|
Δ
Е
|
= 21
,
6
кДж/моль; Н
2
О–пропанол
|
Δ
Е
|
= 2
,
3
кДж/моль
→
Н
2
О–
глицерин
|
Δ
Е
|
= 47
,
7
кДж/моль. Это приводит к значительному
136
ISSN 1812-3368. Вестник МГТУ им. Н.Э. Баумана. Сер. “Естественные науки”. 2015. № 4

















